Explicar a estrutura do átomo sempre foi um sonho dos químicos e físicos. Hoje pode-se dizer que temos uma descrição consiste de como os elétrons se estruturam em volta do núcleo. Mas falta ainda explicar o núcleo e seus constituintes. Esse campo da física abriu espaço para consequüências sem precedentes na física, como as explosões nucleares que ocorreram em Hiroshima e Nagasaki na II Guerra Mundial depois que os Estados Unidos jogaram duas bombas atômicas sobre as cidades. Esse mal uso da ciência é um defeito do ser humano que deve ser coibido com tratados internacionais de não proliferação de armas nucleares, como os já existentes no mundo. Falta apenas as grandes potências respeitá-lo.

Como a fusão nuclear tem uma energia de ativação muito grande, é utilizado uma bomba atômica para ceder a energia necessária para ativar a bomba de fusão. Na década de 50 essas armas termonucleares, que se baseiam na fusão, começaram a ser desenvolvidas, liberando uma energia de 2 a 3 ordens de grandezas maiores que as bombas atômicas.
A descoberta da fissão do urânio que tornou possível a construção da bomba foi anunciada em janeiro de 1939 por dois cientistas alemães, Otto Hahn e F. Strassmann. Diante disso, e já no contexto da II Guerra Mundial, o físico alemão Albert Einstein, usando de todo seus prestígio e fama pelo mundo, manda uma carta para o presidente dos Estados Unidos Franklin D. Roosevelt, no outono de 1939, pedindo que seu governo investisse prioritariamente na pesquisa em armas nucleares. Como resultado, os norte-americanos foram os primeiros a fabricar uma bomba atômica. Este empreendimento, chamado Projeto Manhattan, teve a participação dos governos da Grã-Bretanha, do Canadá e cientistas de várias.
Não demorou muito, e no final da Segunda Guerra Mundial, em 16 de julho de 1945, no deserto do Novo México, os Estados Unidos realizaram o primeiro teste com uma bomba atômica Essa bomba fora feita de plutônio e estimava-se que tinha mil vezes a potência de uma bomba militar convencional. Entretanto, a explosão foi cinqüenta vezes maior do que a estimada. Além disso, a maioria da energia foi liberada em apenas 1 ms, comprovando que a bomba atômica, com elevado poder de destruição, é ideal como arma estratégica. O resultado do teste satisfez uma parte dos políticos e militares que procuravam um poder bélico cada vez maior. Estava iniciada a era nuclear.
Em 6 de agosto de 1945, 21 dias após o primeiro teste atômico, a força aérea norte americana lançou uma bomba atômica sobre a cidade de Hiroshima, no Japão. Isso foi uma represália dos Estados Unidos contra o ataque dos japoneses na base americana de Pearl Harbor. Essa bomba atômica de 235U tinha um poder de 12,5 kilotons. No momento da explosão, cerca de vinte mil pessoas morreram instantaneamente. Milhares de pessoas ainda morreram durante dezenas de anos posteriores devido às conseqüências da radiação nuclear. Existe um caso de uma família que devido a exposição à radiação da bomba sofreu mutação genética. Todos os filhos da família nasceram sem apresentar nenhum pêlo em nenhuma parte do corpo. Um desses filhos se tornou jogador de futebol, tendo algumas passagens pela seleção japonesa.
Não satisfeitos, depois de três dias, em 9 de agosto, os norte-americanos lançaram uma segunda bomba atômica sobre a cidade de Nagasaki. Essa foi uma bomba de plutônio, com potência de 22kiloton. A Segunda Guerra Mundial foi, de fato, uma guerra atômica. Dessa maneira, os Estados Unidos simplesmente arrasaram por completo duas cidades japonesas. A essa altura, Einstein se arrependia profundamente do gesto que fez 6 anos antes.
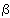 positiva) e de nêutrons em prótons (desintegração
positiva) e de nêutrons em prótons (desintegração 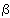 negativa). A interação nuclear forte ou, simplesmente, interação nuclear, é responsável por quase todas as propriedades dos núcleos atômicos mas não produz efeitos diretamente observáveis na experiência cotidiana.
negativa). A interação nuclear forte ou, simplesmente, interação nuclear, é responsável por quase todas as propriedades dos núcleos atômicos mas não produz efeitos diretamente observáveis na experiência cotidiana.
O Átomo Nuclear
 No final do século XIX, o elétron já estava estabelecido como partícula fundamental principalmente depois que, em 1897, J. J. Thomson determinou a sua razão carga / massa. E sabia-se que elétrons eram liberados por emissão termoiônica (de um metal a alta temperatura), no efeito fotoelétrico e no decaimento b de certos elementos radioativos. Evidentemente que os elétrons podiam ser considerados como constituintes básicos dos átomos.
No final do século XIX, o elétron já estava estabelecido como partícula fundamental principalmente depois que, em 1897, J. J. Thomson determinou a sua razão carga / massa. E sabia-se que elétrons eram liberados por emissão termoiônica (de um metal a alta temperatura), no efeito fotoelétrico e no decaimento b de certos elementos radioativos. Evidentemente que os elétrons podiam ser considerados como constituintes básicos dos átomos.
 Para que fosse possível construir tal folha, a maleabilidade do metal deveria ser grande e, por isso, era usado normalmente o ouro. A folha é tão fina que as partículas a atravessam completamente com apenas uma pequena diminuição no módulo da velocidade. Ao atravessar a folha, entretanto, cada partícula a sofre muitos desvios devido a sua interação eletrostática com as cargas positivas e negativas dos átomos da folha. As partículas espalhadas eram detectadas por um microscópio com uma tela de sulfeto de zinco (ZnS). A tela de sulfeto de zinco cintila no local onde incide uma partícula a. O microscópio permite identificar a cintilação de cada partícula a individualmente. Os resultados experimentais de Geiger e Marsden mostraram que o número de partículas a que eram desviadas com ângulos de 90o ou maiores era muito maior que o esperado pelo modelo de Thomson. Em 1911, E. Rutherford mostrou que os dados de Geiger e Marsden eram consistentes com um modelo atômico em que a carga positiva do átomo se concentrava em uma pequena região que, além disso, continha praticamente toda a massa do átomo, com os elétrons espalhados ao redor dessa pequena região (chamada núcleo).
Para que fosse possível construir tal folha, a maleabilidade do metal deveria ser grande e, por isso, era usado normalmente o ouro. A folha é tão fina que as partículas a atravessam completamente com apenas uma pequena diminuição no módulo da velocidade. Ao atravessar a folha, entretanto, cada partícula a sofre muitos desvios devido a sua interação eletrostática com as cargas positivas e negativas dos átomos da folha. As partículas espalhadas eram detectadas por um microscópio com uma tela de sulfeto de zinco (ZnS). A tela de sulfeto de zinco cintila no local onde incide uma partícula a. O microscópio permite identificar a cintilação de cada partícula a individualmente. Os resultados experimentais de Geiger e Marsden mostraram que o número de partículas a que eram desviadas com ângulos de 90o ou maiores era muito maior que o esperado pelo modelo de Thomson. Em 1911, E. Rutherford mostrou que os dados de Geiger e Marsden eram consistentes com um modelo atômico em que a carga positiva do átomo se concentrava em uma pequena região que, além disso, continha praticamente toda a massa do átomo, com os elétrons espalhados ao redor dessa pequena região (chamada núcleo).
 O raio de um núcleo típico é cerca de dez mil vezes menor que o raio do átomo ao qual pertence mas contém mais de 99,9% da massa desse átomo.
O raio de um núcleo típico é cerca de dez mil vezes menor que o raio do átomo ao qual pertence mas contém mais de 99,9% da massa desse átomo.

O núcleo do elemento da tabela periódica de número atômico Z é constituído de Z prótons e N nêutrons. No átomo neutro correspondente, existem ao redor desse núcleo Z elétrons. A = N + Z é o número de núcleons ou, como também é chamado, número de massa.
As massas nucleares são convenientemente expressas em unidades de massa atômica (u). Uma unidade de massa atômica é definida como sendo exatamente um dozeavos da massa de um átomo de carbono 12. Em outras palavras, a massa de um átomo de carbono 12 é, por definição, exatamente 12 u. Em termos numéricos:
1u = 1,6605 x 10-27 kg
A massa de um átomo de carbono 12 vale:
m = ( 12 ) ( 1,6605 x 10-27 kg ) = 1,9926 x 10-26 kg
e esse valor inclui as massas dos prótons, nêutrons e elétrons. A massa de um elétron é:
me = 9,11 x 10-31 kg
de modo que a massa dos 12 elétrons do átomo de carbono 12 é:
m12e = ( 12 ) ( 9,11 x 10-31kg ) = 1,0932 x 10-31 kg
e:
m / m12e = ( 1,9926 x 10-26 kg ) / ( 1,0932 x 10-31 kg ) = 1,8227 x 105
Assim, a massa dos elétrons é desprezível comparada à massa do átomo e a massa do átomo pode ser considerada igual à massa do núcleo atômico. Em termos da unidade de massa atômica, as massas do próton e do nêutron são, respectivamente:
mP = 1,0078 u
mN = 1,0087 u
Com o valor c = 2,9979 x 108 m/s para o módulo da velocidade da luz no vácuo e a relação entre o joule e o megaeletron-volt: 1J = 6,2415 x 1012 MeV, vem:
 uc2 = 931,4815 MeV
uc2 = 931,4815 MeV
mec2 = 511,0244 x 10-3 MeV = 0,5110 MeV
mPc2 = 938,7471 MeV
mNc2 = 939,5854 MeV
R = r0 A1/3
onde r0 é um coeficiente empírico, o mesmo para todos os núcleos, com r0 = 1,4 fm para a distribuição de massa e r0 = 1,2 fm para a distribuição de carga. Aqui usa-se como unidade de comprimento o fermi:
1fm = 10-15 m
Esses números indicam que a distribuição de massa nuclear avança um pouco além da distribuição de carga.
Para o volume do núcleo, temos:
V = 4 R3 / 3 = ( 4
R3 / 3 = ( 4
 03 / 3 ) A
03 / 3 ) A
Como o volume é proporcional ao número de núcleons e o fator de proporcionalidade é o mesmo para todos os núcleos, a distância média entre núcleons é a mesma para todos os núcleos. A densidade da matéria nuclear também é a mesma para todos os núcleos, ou seja, é independente de A:
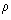 = M / V = Au / ( 4
= M / V = Au / ( 4
 03 / 3 ) A = 3u / 4
03 / 3 ) A = 3u / 4
 03
03
e em números:
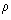 = 3 ( 1,6605 x 10-27 kg ) / 4p ( 1,4 x 10-15 m )3 = 1,4447 x 1017 kg / m3
= 3 ( 1,6605 x 10-27 kg ) / 4p ( 1,4 x 10-15 m )3 = 1,4447 x 1017 kg / m3
Um núcleo não tem, evidentemente, um raio exatamente definido como se poderia inferir da fórmula acima, nem uma densidade constante no interior da esfera definida por esse raio. Na verdade, a densidade nuclear diminui até zero dentro de um intervalo radial cujo centro é dado pela fórmula acima. Por exemplo, para as distribuições de carga e de massa do carbono 12:
RC [ 12C ] = 1,2 (12)1/3 fm 2,7 fm
2,7 fm
RM [ 12C ] = 1,4 (12)1/3 fm 3,2 fm
3,2 fm
e do cobalto 59:
RC [ 59Co ] = 1,2 (59)1/3 fm 4,6 fm
4,6 fm
RM [ 59Co ] = 1,4 (59)1/3 fm 5,4 fm
5,4 fm
 Assim, a uma distância do centro do núcleo de 2,7 fm para o carbono 12 e de 4,6 fm para o cobalto 59, a densidade de carga tem a metade do valor que atinge na região central.
Assim, a uma distância do centro do núcleo de 2,7 fm para o carbono 12 e de 4,6 fm para o cobalto 59, a densidade de carga tem a metade do valor que atinge na região central.
Da relação R = ro A1/3 vem que R3 = ro3 A e daí pode-se concluir que o volume do núcleo é proporcional ao número de núcleons e o número de núcleons por unidade de volume é constante. Portanto, a densidade de núcleons é constante. E como a massa de um próton é muito próxima da massa de um nêutron, a densidade de massa também é constante. E mais, como a interação nuclear forte é independente da carga elétrica, os prótons e os nêutrons estão distribuídos mais ou menos uniformemente no núcleo e a densidade de carga também é constante. Na verdade, nos núcleos com número de massa A grande, a densidade de carga na região central aparece diminuída devido à repulsão coulombiana entre os prótons.
As formas de alguns núcleos afastam-se significativamente da forma esférica e devem ser consideradas elipsoidais ou, mesmo, com a forma de uma pêra.
Por outro lado, a relação E = mc2, que Einstein demonstrou em 1905 e que já está verificada por um grande número de experimentos, significa que se um dado sistema ganha uma certa quantidade de energia E, sua massa aumenta de uma quantidade dada por E / c2, e inversamente, se um dado sistema perde uma certa quantidade de energia E, sua massa fica diminuída de uma quantidade dada por E / c2. Aqui, c representa o módulo da velocidade da luz no vácuo.
Então, sendo E a energia de ligação de um núcleo com Z prótons e ( A - Z ) nêutrons, de massa MZ,A, pode-se escrever:
ZmP + ( A - Z )mN = MZ,A + E / c2
onde mP e mN são, respectivamente, as massas do próton e do nêutron. Daí, a energia de ligação fica:
E = [ ZmP + ( A - Z )mN - MZ,A ] c2
Assim, com as massas determinadas experimentalmente, a energia de ligação de qualquer núcleo pode ser determinada. Por exemplo,como:
mP = 1,0078 u
mN = 1,0087 u
mHe = 4,0026 u
e
uc2 = 931,4815 MeV
a energia de ligação para a partícula a, ou seja, para o hélio 4, fica:
E = [ 2 ( 1,0078 ) + 2 ( 1,0087 ) - 4,0026 ] ( 931,4815 MeV ) = 28,3170 MeV
Estritamente falando, essa é a energia de ligação de um átomo de hélio 4. Contudo, como a energia de ligação dos elétrons ao núcleo é desprezível ( da ordem de 1 eV ), a energia de ligação nuclear é praticamente igual à energia de ligação atômica.
Como outro exemplo, seja a energia de ligação do núcleo lítio 6, cuja massa vale mLi = 6,0151 u:
E = [ 3 ( 1,0078 ) + 3 ( 1,0087 ) - 6,0151 ] ( 931,4815 MeV ) = 32,0430 MeV
Relativamente à dissociação completa, o núcleo lítio 6 é mais estável que o núcleo hélio 4. Contudo, as estruturas nucleares não se dissociam completamente em seus núcleons individuais. No caso de um núcleo naturalmente radioativo (núcleo pai) pode acontecer a dissociação espontânea em um núcleo menor (núcleo filho) e uma partícula a. Por exemplo:
226Ra88 ---> Rn86 + 4He2
Como:
mRa = 226,0254 u
mRn = 222,0175 u
mHe = 4,0026 u
vem:
ERa = [ 88 ( 1,0078 ) + ( 226 - 88 )( 1,0087 ) - 226,0254 ] ( 931,4815 MeV ) = 1734,0460 MeV
e:
ERa+He = [ 88 ( 1,0078 ) + ( 226 - 88 )( 1,0087 ) - 222,0175 - 4,0026 ] ( 931,4815 MeV ) = 1738,9828 MeV
Como a energia de ligação do 226Ra88 é menor do que a soma das energias de ligação do 222Ra86 e do 4He2, a reação indicada acima é realmente espontânea. Deve-se observar que:
ERn+He - ERa = [ - 222,0175 - 4,0026 + 226,0254 ]( 931,4815 MeV ) = + 4,9369 MeV
A massa do rádio 226 é maior do que a soma das massas do radônio 222 e da partícula a. Levando em conta a relação E = mc2, isto significa, em termos energéticos, que o sistema no estado inicial tem uma energia maior do que no estado final, ou seja, o sistema passa de um estado a outro de menor energia e, portanto, mais estável. Por outro lado, em termos da energia de ligação, a diferença ERn+He -- ERa, sendo positiva, indica que, para separar o sistema em seus constituintes básicos, a energia necessária é maior no estado final e, portanto, este é mais estável. De qualquer modo, a reação indicada acima é espontânea.
Agora, seja a reação:
107Ag47 ---> 103Rh45 + 4He2
e sendo:
mAg = 106,9041 u
mRn = 102,9048 u
mHe = 4,0026 u
vem:
ERh+He - EAg = [ - 102,9048 - 4,0026 + 106,9041 ]( 931,4815 MeV ) = - 3,0739 MeV
A massa da prata 107 é menor do que a soma das massas do ródio 103 e da partícula a. Levando em conta a relação E = mc, isto significa, em termos energéticos, que o sistema no estado inicial tem uma energia menor do que no estado final, ou seja, o sistema passaria de um estado a outro de maior energia e, portanto, menos estável. Por outro lado, em termos da energia de ligação, a diferença ERh+He - EAg, sendo negativa, indica que, para separar o sistema em seus constituintes básicos, a energia necessária é menor no estado final e, portanto, este seria menos estável. Assim, de qualquer modo que se pense, a reação indicada não é espontânea. O núcleo prata 107 não pode decair espontaneamente por emissão de partícula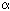 .
.
O que foi mostrado é que a radioatividade natural por decaimento a pode acontecer quando a massa do núcleo pai é maior que a soma das massas do núcleo filho e da partícula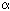 . O mesmo tipo de argumento pode ser feito para discutir a emissão de elétrons ou pósitrons no decaimento
. O mesmo tipo de argumento pode ser feito para discutir a emissão de elétrons ou pósitrons no decaimento 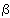 .
.
 56.
56.
Os núcleons são mantidos juntos pela interação nuclear, de caráter atrativo, apesar do efeito contrário da interação coulombiana, de caráter repulsivo, entre os prótons. Como E / A varia muito pouco com o aumento de A para núcleos não muito pequenos, cada núcleon deve interagir atrativamente pela interação nuclear apenas com um certo número de outros núcleons de sua vizinhança imediata, e esse número é independente de A.
 A diminuição lenta de E / A para A > 56 é conseqüência do aumento do número de prótons com o aumento de A e do alcance infinito da interação coulombiana, com cada próton interagindo repulsivamente com todos os outros prótons do núcleo. A diminuição é lenta apesar de o efeito depender do número total de pares de prótons porque a interação coulombiana é cerca de 100 vezes menos intensa que a interação nuclear. Por outro lado, para núcleos com A < 56, E / A diminui cada vez mais rapidamente com a diminuição de A porque, então, diminui cada vez mais rapidamente o número de núcleons na vizinhança imediata de qualquer núcleon, onde a interação nuclear é efetiva. Assim, enquanto a interação nuclear contribui para a estabilidade do núcleo, a interação coulombiana contribui para a sua desestabilização.
A diminuição lenta de E / A para A > 56 é conseqüência do aumento do número de prótons com o aumento de A e do alcance infinito da interação coulombiana, com cada próton interagindo repulsivamente com todos os outros prótons do núcleo. A diminuição é lenta apesar de o efeito depender do número total de pares de prótons porque a interação coulombiana é cerca de 100 vezes menos intensa que a interação nuclear. Por outro lado, para núcleos com A < 56, E / A diminui cada vez mais rapidamente com a diminuição de A porque, então, diminui cada vez mais rapidamente o número de núcleons na vizinhança imediata de qualquer núcleon, onde a interação nuclear é efetiva. Assim, enquanto a interação nuclear contribui para a estabilidade do núcleo, a interação coulombiana contribui para a sua desestabilização.
Como o gráfico da energia de ligação por núcleon em função do número de núcleons apresenta um máximo em A 56, tanto processos de fusão de núcleos leves quanto processos de fissão de núcleos pesados podem levar a liberação de energia e podem, portanto, servir de fundamento tanto para a construção de reatores de geração de energia quanto para a construção de bombas com extremo poder de destruição.
56, tanto processos de fusão de núcleos leves quanto processos de fissão de núcleos pesados podem levar a liberação de energia e podem, portanto, servir de fundamento tanto para a construção de reatores de geração de energia quanto para a construção de bombas com extremo poder de destruição.
16O + 16O ---> 32S
Pela observação do gráfico E / A contra A tem-se aproximadamente 7,8 MeV e 8,6 MeV, respectivamente, para a energia de ligação por núcleon para os núcleos 16O e 32S. Assim, as energias de ligação dos sistemas inicial e final são:
E [ 16O + 16O ] = ( 2 )( 16 )( 7,8 MeV ) = 249,9 MeV
e
E [ 32S ] = ( 32 )( 8,6 MeV ) = 275,2 MeV
Ao passar do estado inicial para o estado final, o sistema sofre uma variação de energia dada por:
DE = E [ 32S ] - E [ 16O + 16O ] = 25,6 MeV
Como E > 0, a energia de ligação do núcleo resultante é maior do que a soma das energias de ligação dos núcleos iniciais. Em outras palavras, como uma energia de 275,2 MeV deve ser fornecida ao sistema no estado final (núcleo 32S) para separá-lo em núcleons infinitamente separados e uma energia de 249,6 MeV deve ser fornecida ao sistema no estado inicial (os dois núcleos 16O) para separá-lo em núcleons infinitamente separados, o sistema deve ter perdido uma energia de 25,6 MeV. Esse resultado se deve ao fato de as energias de ligação por núcleon dos núcleos iniciais serem menores do que a energia de ligação por núcleon do núcleo final, ou seja, a fusão nuclear com liberação de energia só ocorre se o número de núcleons do núcleo resultante é menor ou da ordem de 56, já que a curva E / A contra A tem máximo em A
E > 0, a energia de ligação do núcleo resultante é maior do que a soma das energias de ligação dos núcleos iniciais. Em outras palavras, como uma energia de 275,2 MeV deve ser fornecida ao sistema no estado final (núcleo 32S) para separá-lo em núcleons infinitamente separados e uma energia de 249,6 MeV deve ser fornecida ao sistema no estado inicial (os dois núcleos 16O) para separá-lo em núcleons infinitamente separados, o sistema deve ter perdido uma energia de 25,6 MeV. Esse resultado se deve ao fato de as energias de ligação por núcleon dos núcleos iniciais serem menores do que a energia de ligação por núcleon do núcleo final, ou seja, a fusão nuclear com liberação de energia só ocorre se o número de núcleons do núcleo resultante é menor ou da ordem de 56, já que a curva E / A contra A tem máximo em A  56.
56.
n + 235U ---> [ 236U ] ---> 97Rb + 137Cs + 2n
Pela observação do gráfico E / A contra A tem-se aproximadamente 7,7 MeV e 8,6 MeV e 8,2 MeV, respectivamente, para os núcleos 236U e 97Rb e137Cs. Assim, as energias de ligação dos sistemas inicial e final são:
E [ 236U ] = ( 236 )( 7,7 MeV ) = 1817,2 MeV
e
E [ 97Rb + 137Cs + 2n ] = ( 97 )( 8,6 MeV ) + ( 137 )( 8,2 MeV ) + ( 2 )( 7,7 MeV ) = 1973,0 MeV
Ao passar do estado inicial para o estado final, o sistema sofre uma variação de energia dada por:
 E = E [ 97Rb + 137137Cs + 2n ] - E [ 236U ] = 1973,0 MeV - 1817,2 MeV = 155,8 MeV
E = E [ 97Rb + 137137Cs + 2n ] - E [ 236U ] = 1973,0 MeV - 1817,2 MeV = 155,8 MeV
Como E > 0, o sistema deve ter perdido uma energia de 155,8 MeV. Novamente, esse resultado se deve ao fato de a energia de ligação por núcleon do núcleo inicial (o núcleo composto [ 236U ]) ser menor do que a soma das energias de ligação por núcleon dos núcleos finais e dos dois nêutrons, ou seja, a fissão nuclear com liberação de energia só ocorre se o número de núcleons dos núcleos resultantes é maior ou da ordem de 56. Este cálculo é aproximado e é o que se pode fazer a partir do gráfico considerado. Na realidade, a energia total liberada na reação é maior porque os núcleos resultantes são instáveis e decaem, posteriormente, por emissão de elétrons, neutrinos e raios
E > 0, o sistema deve ter perdido uma energia de 155,8 MeV. Novamente, esse resultado se deve ao fato de a energia de ligação por núcleon do núcleo inicial (o núcleo composto [ 236U ]) ser menor do que a soma das energias de ligação por núcleon dos núcleos finais e dos dois nêutrons, ou seja, a fissão nuclear com liberação de energia só ocorre se o número de núcleons dos núcleos resultantes é maior ou da ordem de 56. Este cálculo é aproximado e é o que se pode fazer a partir do gráfico considerado. Na realidade, a energia total liberada na reação é maior porque os núcleos resultantes são instáveis e decaem, posteriormente, por emissão de elétrons, neutrinos e raios 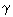 .
.

Erupções solares, fotografada pelo satélite SOHO
(Solar and Heliospheric Observatory)
Nas reações nucleares, há uma extraordinária quantidade de energia envolvida. Reside ai o incrível poder destrutivo das bombas nucleares. Estas podem ser de fissão, chamadas bombas atômicas, ou de fusão, chamadas de bomba de hidrogênio. O sol, veja foto acima, gera energia realizando fusão nuclear. Em seu núcleo, cerca de 69 milhões de toneladas de hidrogênio se fundem, formando 65 milhões de toneladas de hélio, a cada segundo!!!!. Essas 4 milhões de tonelada hidrogênio que sobram se transormam em energia.É uma quantidade de energia que foge aos limites do pensamento humano. Estimativas mostram que essa energia poderia abastecer toda a rede elétrica dos Estados Unidos atual por um período de nada menos que 13 milhões de anos!!!(Solar and Heliospheric Observatory)
Armas Nucleares
Os processos nucleares observados até hoje são a fissão e a fusão. A fissão é de mais fácil controle, tem uma menor energia de ativação e liberam uma quantidade muito grande de energia, porém menor que a fusão. A bomba atômica se baseia na fissão de um material, como o urânio.Como a fusão nuclear tem uma energia de ativação muito grande, é utilizado uma bomba atômica para ceder a energia necessária para ativar a bomba de fusão. Na década de 50 essas armas termonucleares, que se baseiam na fusão, começaram a ser desenvolvidas, liberando uma energia de 2 a 3 ordens de grandezas maiores que as bombas atômicas.
A descoberta da fissão do urânio que tornou possível a construção da bomba foi anunciada em janeiro de 1939 por dois cientistas alemães, Otto Hahn e F. Strassmann. Diante disso, e já no contexto da II Guerra Mundial, o físico alemão Albert Einstein, usando de todo seus prestígio e fama pelo mundo, manda uma carta para o presidente dos Estados Unidos Franklin D. Roosevelt, no outono de 1939, pedindo que seu governo investisse prioritariamente na pesquisa em armas nucleares. Como resultado, os norte-americanos foram os primeiros a fabricar uma bomba atômica. Este empreendimento, chamado Projeto Manhattan, teve a participação dos governos da Grã-Bretanha, do Canadá e cientistas de várias.
Não demorou muito, e no final da Segunda Guerra Mundial, em 16 de julho de 1945, no deserto do Novo México, os Estados Unidos realizaram o primeiro teste com uma bomba atômica Essa bomba fora feita de plutônio e estimava-se que tinha mil vezes a potência de uma bomba militar convencional. Entretanto, a explosão foi cinqüenta vezes maior do que a estimada. Além disso, a maioria da energia foi liberada em apenas 1 ms, comprovando que a bomba atômica, com elevado poder de destruição, é ideal como arma estratégica. O resultado do teste satisfez uma parte dos políticos e militares que procuravam um poder bélico cada vez maior. Estava iniciada a era nuclear.
Em 6 de agosto de 1945, 21 dias após o primeiro teste atômico, a força aérea norte americana lançou uma bomba atômica sobre a cidade de Hiroshima, no Japão. Isso foi uma represália dos Estados Unidos contra o ataque dos japoneses na base americana de Pearl Harbor. Essa bomba atômica de 235U tinha um poder de 12,5 kilotons. No momento da explosão, cerca de vinte mil pessoas morreram instantaneamente. Milhares de pessoas ainda morreram durante dezenas de anos posteriores devido às conseqüências da radiação nuclear. Existe um caso de uma família que devido a exposição à radiação da bomba sofreu mutação genética. Todos os filhos da família nasceram sem apresentar nenhum pêlo em nenhuma parte do corpo. Um desses filhos se tornou jogador de futebol, tendo algumas passagens pela seleção japonesa.
Não satisfeitos, depois de três dias, em 9 de agosto, os norte-americanos lançaram uma segunda bomba atômica sobre a cidade de Nagasaki. Essa foi uma bomba de plutônio, com potência de 22kiloton. A Segunda Guerra Mundial foi, de fato, uma guerra atômica. Dessa maneira, os Estados Unidos simplesmente arrasaram por completo duas cidades japonesas. A essa altura, Einstein se arrependia profundamente do gesto que fez 6 anos antes.
Fonte: www.ifi.unicamp.br
Física Nuclear
A interação gravitacional é responsável pelas estruturas muito grandes, como as galáxias, sistemas planetários e estelares. Na experiência cotidiana, a interação gravitacional aparece como o peso dos corpos. A interação eletromagnética é responsável pelas propriedades gerais dos átomos e das moléculas, dos sistemas em que átomos e moléculas aparecem agregados em líquidos e sólidos, e pelas propriedades químicas das substâncias. Na experiência cotidiana, a interação eletromagnética aparece como o atrito, a normal, a viscosidade e as forças elásticas. A interação nuclear fraca ou, simplesmente, interação fraca, é responsável pela transformação espontânea de prótons em nêutrons (desintegraçãoO Átomo Nuclear

Modelo de Thomson
No modelo de J. J. Thomson, proposto em 1904, o átomo era considerado como um tipo de fluido com uma distribuição esférica contínua de carga positiva onde se incrustavam os elétrons, com carga negativa, em número suficiente para neutralizar a carga positiva. O modelo tinha como hipótese a existência de configurações estáveis para os elétrons ao redor das quais estes oscilariam. Contudo, segundo a teoria eletromagnética clássica, não pode existir qualquer configuração estável num sistema de partículas carregadas se a única interação entre elas é de caráter eletromagnético. Além disso, como qualquer partícula com carga elétrica em movimento acelerado emite radiação eletromagnética, o modelo tinha como outra hipótese que os modos normais das oscilações dos elétrons deveriam ter as mesmas freqüências que aquelas que se observavam associadas às raias dos espectros atômicos. Mas não foi encontrada qualquer configuração para os elétrons de qualquer átomo cujos modos normais tivessem qualquer uma das freqüências esperadas. De qualquer modo, o modelo de Thomson foi abandonado principalmente devido aos resultados das experiências de H. Geiger e E. Marsden.Experimento de Rutherford
Na época em que J. J. Thomson propôs seu modelo, H. Geiger e E. Marsden estudavam o espalhamento de feixes bem colimados de partículas a, que já se sabia serem núcleos de átomos de hélio (He++), por finas folhas de ouro, pelo que hoje se conhece como a experiência de Rutherford. Uma fonte radioativa emite partículas a que são colimadas, formando um feixe paralelo e estreito, que incide sobre uma folha metálica muito pouco espessa.

Características Gerais do Núcleo

Constituição
O núcleo atômico é composto de partículas chamadas núcleons. Existem duas espécies de núcleons: os prótons, com carga elétrica positiva, e os nêutrons, sem carga elétrica. Prótons e nêutrons têm spin ½ e obedecem ao princípio de exclusão de Pauli.O núcleo do elemento da tabela periódica de número atômico Z é constituído de Z prótons e N nêutrons. No átomo neutro correspondente, existem ao redor desse núcleo Z elétrons. A = N + Z é o número de núcleons ou, como também é chamado, número de massa.
As massas nucleares são convenientemente expressas em unidades de massa atômica (u). Uma unidade de massa atômica é definida como sendo exatamente um dozeavos da massa de um átomo de carbono 12. Em outras palavras, a massa de um átomo de carbono 12 é, por definição, exatamente 12 u. Em termos numéricos:
1u = 1,6605 x 10-27 kg
A massa de um átomo de carbono 12 vale:
m = ( 12 ) ( 1,6605 x 10-27 kg ) = 1,9926 x 10-26 kg
e esse valor inclui as massas dos prótons, nêutrons e elétrons. A massa de um elétron é:
me = 9,11 x 10-31 kg
de modo que a massa dos 12 elétrons do átomo de carbono 12 é:
m12e = ( 12 ) ( 9,11 x 10-31kg ) = 1,0932 x 10-31 kg
e:
m / m12e = ( 1,9926 x 10-26 kg ) / ( 1,0932 x 10-31 kg ) = 1,8227 x 105
Assim, a massa dos elétrons é desprezível comparada à massa do átomo e a massa do átomo pode ser considerada igual à massa do núcleo atômico. Em termos da unidade de massa atômica, as massas do próton e do nêutron são, respectivamente:
mP = 1,0078 u
mN = 1,0087 u
Com o valor c = 2,9979 x 108 m/s para o módulo da velocidade da luz no vácuo e a relação entre o joule e o megaeletron-volt: 1J = 6,2415 x 1012 MeV, vem:

mec2 = 511,0244 x 10-3 MeV = 0,5110 MeV
mPc2 = 938,7471 MeV
mNc2 = 939,5854 MeV
Isótopos
Isótopos são núcleos associados ao mesmo elemento da tabela periódica (mesmo número atômico) mas com diferentes números de nêutrons. Por exemplo, ao elemento hidrogênio (Z = 1) estão associados isótopos com N = 0, N = 1 (deutério) e N = 2 (trítio), referidos, também, pelo número de massa: hidrogênio 1, hidrogênio 2 e hidrogênio 3, e ao elemento oxigênio (Z = 8) estão associados isótopos com N = 7, N = 8, N = 9 e N = 10, referidos pelo número de massa: oxigênio 15, oxigênio 16, oxigênio 17 e oxigênio 18. Aos 112 elementos conhecidos estão associados uns 270 isótopos estáveis e mais de 2.000 instáveis.Isóbaros
Isóbaros são núcleos associados a elementos diferentes da tabela periódica mas com iguais números de massa. Por exemplo, os núcleos berílio 10 (Z = 4, N = 6), boro 10 (Z = 5,N = 5) e carbono 10 (Z = 6, N = 4) são núcleos isóbaros.Simbologia
É usual representar o núcleo de número de massa A e número atômico Z por AXZ ou simplesmente AX, onde X é o símbolo do elemento correspondente. Por exemplo, o núcleo oxigênio 17 é representado por 17O8 ou, simplesmente,17O. O número de nêutrons N não precisa ser representado porque N = A - Z.Tamanho
As técnicas mais importantes para a determinação do raio nuclear são aquelas que incluem o espalhamento de nêutrons e elétrons. Como os nêutrons não têm carga elétrica, não são influenciados pela interação coulombiana nem com os nêutrons nem com os prótons do núcleo. Mas como são influenciados pela interação nuclear tanto com os nêutrons quanto com os prótons do núcleo, os nêutrons espalhados sondam a distribuição de massa do núcleo. Por outro lado, os elétrons não são influenciados pela interação nuclear nem com os nêutrons nem com os prótons do núcleo. Mas, como têm carga elétrica não nula, são influenciados pela interação coulombiana com os prótons do núcleo e sondam, assim, a distribuição de carga do núcleo. O raio de um núcleo com número de massa A, suposto esférico, é dado, com precisão considerável, por:R = r0 A1/3
onde r0 é um coeficiente empírico, o mesmo para todos os núcleos, com r0 = 1,4 fm para a distribuição de massa e r0 = 1,2 fm para a distribuição de carga. Aqui usa-se como unidade de comprimento o fermi:
1fm = 10-15 m
Esses números indicam que a distribuição de massa nuclear avança um pouco além da distribuição de carga.
Para o volume do núcleo, temos:
V = 4
Como o volume é proporcional ao número de núcleons e o fator de proporcionalidade é o mesmo para todos os núcleos, a distância média entre núcleons é a mesma para todos os núcleos. A densidade da matéria nuclear também é a mesma para todos os núcleos, ou seja, é independente de A:
e em números:
Um núcleo não tem, evidentemente, um raio exatamente definido como se poderia inferir da fórmula acima, nem uma densidade constante no interior da esfera definida por esse raio. Na verdade, a densidade nuclear diminui até zero dentro de um intervalo radial cujo centro é dado pela fórmula acima. Por exemplo, para as distribuições de carga e de massa do carbono 12:
RC [ 12C ] = 1,2 (12)1/3 fm
RM [ 12C ] = 1,4 (12)1/3 fm
e do cobalto 59:
RC [ 59Co ] = 1,2 (59)1/3 fm
RM [ 59Co ] = 1,4 (59)1/3 fm

Da relação R = ro A1/3 vem que R3 = ro3 A e daí pode-se concluir que o volume do núcleo é proporcional ao número de núcleons e o número de núcleons por unidade de volume é constante. Portanto, a densidade de núcleons é constante. E como a massa de um próton é muito próxima da massa de um nêutron, a densidade de massa também é constante. E mais, como a interação nuclear forte é independente da carga elétrica, os prótons e os nêutrons estão distribuídos mais ou menos uniformemente no núcleo e a densidade de carga também é constante. Na verdade, nos núcleos com número de massa A grande, a densidade de carga na região central aparece diminuída devido à repulsão coulombiana entre os prótons.
As formas de alguns núcleos afastam-se significativamente da forma esférica e devem ser consideradas elipsoidais ou, mesmo, com a forma de uma pêra.
Energia de Ligação Nuclear
Dado um núcleo qualquer, a energia liberada quando da sua formação a partir dos seus prótons e nêutrons separados de uma distância infinita ou, o que dá no mesmo, a energia que deve ser fornecida a esse núcleo para separar seus prótons e nêutrons de uma distância infinita é o que se chama de energia de ligação de tal núcleo.Por outro lado, a relação E = mc2, que Einstein demonstrou em 1905 e que já está verificada por um grande número de experimentos, significa que se um dado sistema ganha uma certa quantidade de energia E, sua massa aumenta de uma quantidade dada por E / c2, e inversamente, se um dado sistema perde uma certa quantidade de energia E, sua massa fica diminuída de uma quantidade dada por E / c2. Aqui, c representa o módulo da velocidade da luz no vácuo.
Então, sendo E a energia de ligação de um núcleo com Z prótons e ( A - Z ) nêutrons, de massa MZ,A, pode-se escrever:
ZmP + ( A - Z )mN = MZ,A + E / c2
onde mP e mN são, respectivamente, as massas do próton e do nêutron. Daí, a energia de ligação fica:
E = [ ZmP + ( A - Z )mN - MZ,A ] c2
Assim, com as massas determinadas experimentalmente, a energia de ligação de qualquer núcleo pode ser determinada. Por exemplo,como:
mP = 1,0078 u
mN = 1,0087 u
mHe = 4,0026 u
e
uc2 = 931,4815 MeV
a energia de ligação para a partícula a, ou seja, para o hélio 4, fica:
E = [ 2 ( 1,0078 ) + 2 ( 1,0087 ) - 4,0026 ] ( 931,4815 MeV ) = 28,3170 MeV
Estritamente falando, essa é a energia de ligação de um átomo de hélio 4. Contudo, como a energia de ligação dos elétrons ao núcleo é desprezível ( da ordem de 1 eV ), a energia de ligação nuclear é praticamente igual à energia de ligação atômica.
Como outro exemplo, seja a energia de ligação do núcleo lítio 6, cuja massa vale mLi = 6,0151 u:
E = [ 3 ( 1,0078 ) + 3 ( 1,0087 ) - 6,0151 ] ( 931,4815 MeV ) = 32,0430 MeV
Relativamente à dissociação completa, o núcleo lítio 6 é mais estável que o núcleo hélio 4. Contudo, as estruturas nucleares não se dissociam completamente em seus núcleons individuais. No caso de um núcleo naturalmente radioativo (núcleo pai) pode acontecer a dissociação espontânea em um núcleo menor (núcleo filho) e uma partícula a. Por exemplo:
226Ra88 ---> Rn86 + 4He2
Como:
mRa = 226,0254 u
mRn = 222,0175 u
mHe = 4,0026 u
vem:
ERa = [ 88 ( 1,0078 ) + ( 226 - 88 )( 1,0087 ) - 226,0254 ] ( 931,4815 MeV ) = 1734,0460 MeV
e:
ERa+He = [ 88 ( 1,0078 ) + ( 226 - 88 )( 1,0087 ) - 222,0175 - 4,0026 ] ( 931,4815 MeV ) = 1738,9828 MeV
Como a energia de ligação do 226Ra88 é menor do que a soma das energias de ligação do 222Ra86 e do 4He2, a reação indicada acima é realmente espontânea. Deve-se observar que:
ERn+He - ERa = [ - 222,0175 - 4,0026 + 226,0254 ]( 931,4815 MeV ) = + 4,9369 MeV
A massa do rádio 226 é maior do que a soma das massas do radônio 222 e da partícula a. Levando em conta a relação E = mc2, isto significa, em termos energéticos, que o sistema no estado inicial tem uma energia maior do que no estado final, ou seja, o sistema passa de um estado a outro de menor energia e, portanto, mais estável. Por outro lado, em termos da energia de ligação, a diferença ERn+He -- ERa, sendo positiva, indica que, para separar o sistema em seus constituintes básicos, a energia necessária é maior no estado final e, portanto, este é mais estável. De qualquer modo, a reação indicada acima é espontânea.
Agora, seja a reação:
107Ag47 ---> 103Rh45 + 4He2
e sendo:
mAg = 106,9041 u
mRn = 102,9048 u
mHe = 4,0026 u
vem:
ERh+He - EAg = [ - 102,9048 - 4,0026 + 106,9041 ]( 931,4815 MeV ) = - 3,0739 MeV
A massa da prata 107 é menor do que a soma das massas do ródio 103 e da partícula a. Levando em conta a relação E = mc, isto significa, em termos energéticos, que o sistema no estado inicial tem uma energia menor do que no estado final, ou seja, o sistema passaria de um estado a outro de maior energia e, portanto, menos estável. Por outro lado, em termos da energia de ligação, a diferença ERh+He - EAg, sendo negativa, indica que, para separar o sistema em seus constituintes básicos, a energia necessária é menor no estado final e, portanto, este seria menos estável. Assim, de qualquer modo que se pense, a reação indicada não é espontânea. O núcleo prata 107 não pode decair espontaneamente por emissão de partícula
O que foi mostrado é que a radioatividade natural por decaimento a pode acontecer quando a massa do núcleo pai é maior que a soma das massas do núcleo filho e da partícula
Energia de Ligação por Núcleon
Uma indicação da estabilidade nuclear resultante das interações coulombiana e nuclear forte é dada pelo gráfico da energia de ligação por núcleon, E / A, em função do número de núcleons, A. O gráfico de E / A contra A inclui tanto núcleos estáveis quanto núcleos radioativos. O núcleo com a menor energia de ligação por núcleon é o hidrogênio 2 (deutério) e o núcleo com a maior energia de ligação por núcleon é o ferro 56. Assim, esse gráfico tem um máximo em AOs núcleons são mantidos juntos pela interação nuclear, de caráter atrativo, apesar do efeito contrário da interação coulombiana, de caráter repulsivo, entre os prótons. Como E / A varia muito pouco com o aumento de A para núcleos não muito pequenos, cada núcleon deve interagir atrativamente pela interação nuclear apenas com um certo número de outros núcleons de sua vizinhança imediata, e esse número é independente de A.

Como o gráfico da energia de ligação por núcleon em função do número de núcleons apresenta um máximo em A
Fusão Nuclear
Fusão nuclear é o processo de formação de um núcleo a partir da colisão e posterior junção de dois núcleos menores. Os núcleos que colidem devem ter, inicialmente, uma energia cinética que lhes permita se aproximar contra a repulsão coulombiana o suficiente para que a interação nuclear forte passe a ser efetiva e mais importante. Como a repulsão coulombiana é tanto mais importante quanto maior a carga elétrica dos núcleos em colisão, a fusão nuclear pode ser provocada com mais facilidade entre núcleos com número pequeno de prótons. De qualquer modo, a fusão nuclear com liberação de energia só ocorre se o número de núcleons do núcleo resultante é menor ou da ordem de 56. A título de exemplo, seja a fusão de dois núcleos de oxigênio 16 para formar um núcleo de enxofre 32:16O + 16O ---> 32S
Pela observação do gráfico E / A contra A tem-se aproximadamente 7,8 MeV e 8,6 MeV, respectivamente, para a energia de ligação por núcleon para os núcleos 16O e 32S. Assim, as energias de ligação dos sistemas inicial e final são:
E [ 16O + 16O ] = ( 2 )( 16 )( 7,8 MeV ) = 249,9 MeV
e
E [ 32S ] = ( 32 )( 8,6 MeV ) = 275,2 MeV
Ao passar do estado inicial para o estado final, o sistema sofre uma variação de energia dada por:
DE = E [ 32S ] - E [ 16O + 16O ] = 25,6 MeV
Como
Fissão Nuclear
Fissão nuclear é o processo de divisão de um núcleo em dois núcleos menores, de tamanho comparável. Os núcleos com um grande número de núcleons estão sujeitos à fissão espontânea, com uma probabilidade muito pequena, e sujeitos à fissão induzida por captura de nêutrons, com uma probabilidade maior. A título de exemplo, seja a reação de fissão de um núcleo de urânio 235 em um núcleo de rubídio 97 e um núcleo de Césio 137:n + 235U ---> [ 236U ] ---> 97Rb + 137Cs + 2n
Pela observação do gráfico E / A contra A tem-se aproximadamente 7,7 MeV e 8,6 MeV e 8,2 MeV, respectivamente, para os núcleos 236U e 97Rb e137Cs. Assim, as energias de ligação dos sistemas inicial e final são:
E [ 236U ] = ( 236 )( 7,7 MeV ) = 1817,2 MeV
e
E [ 97Rb + 137Cs + 2n ] = ( 97 )( 8,6 MeV ) + ( 137 )( 8,2 MeV ) + ( 2 )( 7,7 MeV ) = 1973,0 MeV
Ao passar do estado inicial para o estado final, o sistema sofre uma variação de energia dada por:
Como
>
Deixe seu Comentrio:
Temos Atualmente:
Temos Atualmente:
>
Categorias:
Assinar:
Postar comentários (Atom)







0 comentários:
Postar um comentário